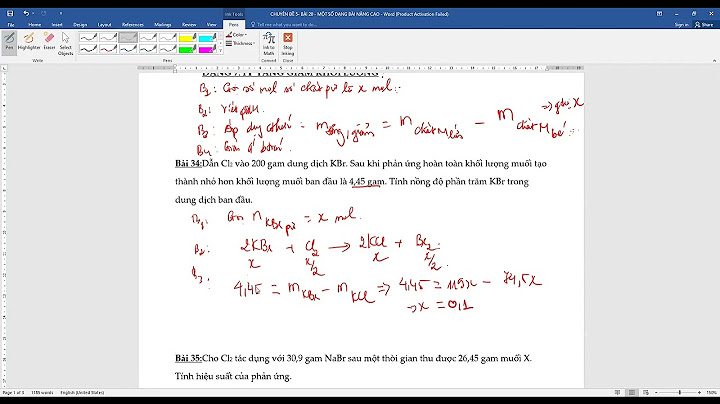
Dãy hoạt động hóa học của kim loại là một công cụ thực nghiệm dùng để dự đoán sản phẩm trong các phản ứng dịch chuyển và khả năng phản ứng của kim loại với nước và axit trong các phản ứng thay thế và khai thác quặng. Nó có thể được sử dụng để dự đoán các sản phẩm trong các phản ứng tương tự liên quan đến một kim loại khác. Show
.jpg) Khám phá dãy hoạt động hóa học của kim loạiDãy điện hóa là biểu đồ các kim loại được liệt kê theo thứ tự giảm dần khả năng phản ứng. Các kim loại phía trên phản ứng mạnh hơn các kim loại ở phía dưới. Ví dụ, cả magie và kẽm đều có thể phản ứng với các ion hydro để đẩy H2 ra khỏi dung dịch bằng các phản ứng:
Cả hai kim loại đều phản ứng với các ion hydro, nhưng kim loại magie cũng có thể thay thế các ion kẽm trong dung dịch bằng phản ứng:
Điều này cho thấy magie hoạt động mạnh hơn kẽm và cả hai kim loại đều hoạt động mạnh hơn hydro. Phản ứng dịch chuyển thứ ba này có thể được sử dụng cho bất kỳ kim loại nào có vẻ thấp hơn chính nó trên bàn. Hai kim loại càng xuất hiện xa nhau thì phản ứng càng mạnh. Thêm một kim loại như đồng vào các ion kẽm sẽ không thay thế kẽm vì đồng có vẻ thấp hơn kẽm trên bàn cân. Năm nguyên tố đầu tiên là những kim loại có tính phản ứng cao sẽ phản ứng với nước lạnh, nước nóng và hơi nước để tạo thành khí hydro và hydroxit. Bốn kim loại tiếp theo (magiê đến crom) là những kim loại hoạt động sẽ phản ứng với nước nóng hoặc hơi nước để tạo thành oxit và khí hydro. Tất cả các oxit của hai nhóm kim loại này đều có khả năng chống lại sự khử của khí H2. Sáu kim loại từ sắt đến chì sẽ thay thế hydro từ axit clohiđric, axit sunfuric và axit nitric. Các oxit của chúng có thể được khử bằng cách đun nóng bằng khí hydro, cacbon và cacbon monoxit. Tất cả các kim loại từ lithium đến đồng sẽ dễ dàng kết hợp với oxy để tạo thành oxit của chúng. Năm kim loại cuối cùng được tìm thấy ở dạng tự do với rất ít oxit. Các oxit của chúng hình thành thông qua các con đường thay thế và sẽ dễ dàng phân hủy dưới tác dụng của nhiệt. Biểu đồ chuỗi bên dưới hoạt động rất hiệu quả đối với các phản ứng xảy ra ở nhiệt độ hoặc gần nhiệt độ phòng và trong dung dịch nước. Dãy hoạt động hóa học của kim loại hoặc dãy điện hóa là danh sách các kim loại từ phản ứng mạnh nhất đến ít phản ứng nhất. Biết dãy hoạt động giúp bạn dự đoán liệu phản ứng hóa học có xảy ra hay không. Cụ thể, sử dụng nó để xác định xem kim loại có phản ứng với nước hay axit hay không hoặc liệu nó có thay thế kim loại khác trong phản ứng hay không. Phản ứng thay thế và khai thác quặng là hai ứng dụng chính của dãy điện hóa. Dãy hoạt động hóa học của kim loại là gì?1. Phản ứng với nước lạnh, thay thế hydro và tạo thành hydroxit - Cesium (Cs), Francium (Fr), Rubidium (Rb), Potassium (K) , Sodium (Na) ,Lithium (Li) ,Barium (Ba) ,Radium (Ra) ,Strontium (Sr) ,Calcium (Ca) 2.Phản ứng rất chậm với nước lạnh, nhưng mạnh với axit, tạo thành hydroxit - Magnesium (Mg) 3.Phản ứng với axit, thường tạo thành oxit - Beryllium (Be),Aluminum (Al),Titanium (Ti),Manganese (Mn),Zinc (Zn),Chromium (Cr),Iron (Fe),Cadmium (Cd),Cobalt (Co),Nickel (Ni),Tin (Sn),Lead (Pb) 4.Để so sánh - H2 hydro được cho vào để so sánh các kim loại hoạt động yếu và trung bình. 5.Rất kém phản ứng (Sb phản ứng với một số axit oxy hóa) - Antimony (Sb),Bismuth (Bi),Copper (Cu),Tungsten (W),Mercury (Hg),Silver (Ag),Gold (Au),Platinum (Pt) .jpg) Nếu nhìn xung quanh, bạn sẽ nhận thấy biểu đồ từ các nguồn khác nhau có thể sắp xếp các phần tử hơi khác nhau. Ví dụ: trong một số biểu đồ, bạn sẽ thấy natri được liệt kê là có tính phản ứng mạnh hơn kali. Điều này là do các điều kiện của một phản ứng được đề xuất có vấn đề. Thứ tự của các kim loại trong bảng xuất phát từ dữ liệu thực nghiệm về khả năng thay thế hydro khỏi nước và axit của kim loại. Các kim loại đặc biệt phản ứng với axit này nhiều hơn axit khác, cộng với nhiệt độ đóng một vai trò nào đó. Điều quan trọng là ghi nhớ các xu hướng chung. Kim loại kiềm có hoạt tính mạnh hơn kim loại kiềm thổ, do đó kiềm thổ có tính kim loại mạnh hơn kim loại chuyển tiếp. Kim loại quý (Au, Ag) ít phản ứng nhất. Các kim loại kiềm, bari, radium, stronti và canxi phản ứng với nước lạnh. Magie chỉ phản ứng chậm với nước lạnh mà phản ứng nhanh với nước sôi hoặc axit. Beryllium và nhôm phản ứng với hơi nước hoặc axit. Titan chỉ phản ứng với axit khoáng đậm đặc. Hầu hết các kim loại chuyển tiếp phản ứng với axit nhưng không phản ứng với hơi nước. Các kim loại quý chỉ phản ứng với các chất oxy hóa mạnh, chẳng hạn như nước cường toan. Kim loại phản ứng mạnh nhất và yếu nhấtTừ bảng, lưu ý rằng kim loại phản ứng mạnh nhất trong bảng tuần hoàn là Caesium. Kim loại ít phản ứng nhất là bạch kim. Ứng dụng của dãy điện hóaVì vậy, kim loại có vị trí cao hơn trong chuỗi hoạt động sẽ thay thế kim loại có vị trí thấp hơn trong dãy hoạt động. Nó không thay thế kim loại cao hơn trên dãy điện hóa. Khi một kim loại thay thế kim loại khác, nó sẽ thay thế kim loại đó trong các phản ứng thay thế và cũng thay thế các ion trong dung dịch nước. Ví dụ, thêm kim loại kẽm vào dung dịch ion đồng sẽ tạo ra kết tủa đồng:
Điều này xảy ra vì kẽm có tính phản ứng mạnh hơn đồng và cao hơn trong dãy hoạt động. Tuy nhiên, nếu bạn thêm kim loại bạc vào dung dịch đồng nước thì không có gì thay đổi. Bạc thấp hơn đồng trong dãy hoạt động nên không xảy ra phản ứng hóa học. Tuy nhiên, một số kim loại không đẩy hydro ra khỏi nước. Kim loại có bậc hoạt động thấp hơn sẽ phản ứng với axit. Ví dụ, kẽm thay thế hydro khỏi axit sulfuric:
Làm bài tập về dãy điện hóaBây giờ, hãy áp dụng thông tin này vào các vấn đề hóa học tiềm ẩn: Ví dụ 1Phản ứng sau có xảy ra không?
Magiê có chuỗi hoạt động cao hơn đồng nên nó thay thế nó trong các phản ứng. Có, phản ứng này sẽ xảy ra. Ví dụ 2Điều gì xảy ra khi cho một miếng kẽm vào bình chứa axit clohiđric?
Zn(s) + 2 HCl(aq) → Zn2+(aq) + 2 Cl–(aq) + H2(g) Ví dụ 3
Từ chuỗi phản ứng, bạn biết đồng khá kém phản ứng. Không có phản ứng xảy ra. Chẳng có gì xảy ra. Bản chất của dãy hoạt động hóa học của kim loạiLý do một số kim loại có khả năng phản ứng mạnh hơn các kim loại khác liên quan đến cấu hình electron của chúng. Các kim loại kiềm dễ dàng mất electron hóa trị đơn và đạt được độ ổn định. Trong khi đó, kim loại quý là nguyên tố khối d đòi hỏi phải mất hoặc thu thêm một số electron để đạt được cấu hình khí hiếm. Thông thường, kim loại có nhiều electron hơn sẽ phản ứng mạnh hơn kim loại có ít electron hơn. Điều này là do kim loại có nhiều electron hơn có lớp vỏ electron ở xa hạt nhân hơn nên các electron của chúng không liên kết chặt chẽ với nhau. Dãy hoạt động hóa học của kim loại cho biết gì?Dãy hoạt động hóa học của kim loại cho biết: - Mức độ hoạt động hóa học của các kim loại giảm dần từ trái sang phải. - Những kim loại đứng trước Mg là những kim loại mạnh (ví dụ: K, Na, Ba,..), tác dụng với nước ở điều kiện thường tạo thành kiềm và giải phóng H2. Có bao nhiêu kim loại tác dụng được với nước?Kim loại tác dụng với nước:. Kim loại có thể tác dụng với nước: K, Ba, Ca, Na, Mg.. Ở nhiệt độ thường không có phản ứng với nước: Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au.. Kim loại yếu là kim loại gì?Kim loại yếu gồm những nguyên tố hóa học Al, Ga, In, Sn, Tl, Pb, Bi, Fl; chúng nằm giữa kim loại và á kim trong bảng tuần hoàn. Vì đứng trước á kim trong bảng tuần hoàn nên các kim loại này sẽ có các tính chất vật lý như nhiệt độ nóng chảy... Kim loại H2O ra gì?💦 H2O (nước) tác dụng với kim loại: Trong điều kiện nhiệt độ thường nước có khả năng tác dụng với một số kim loại như: Li, Na, K, Ca,… Kết quả phản ứng sẽ tạo thành bazơ và khí H2. |